Jedným z mnohých fyzikálno-chemických procesov, ktoré si našli široké uplatnenie v priemysle i v každodennom živote, je elektrolýza - výber povrchov elektród pripojených k zdroju prúdu umiestneného v roztoku alebo tavenine, ich zložiek (čistý kov - hliník, meď, plyn atď.). Hlavnou inštaláciou, v ktorej sa tento proces uskutočňuje, je elektrolyzér.

Elektrolyzér
Čo je to elektrolyzér
Elektrolyzér je špeciálne zariadenie, ktoré sa používa na oddelenie jeho zložiek od roztoku alebo taveniny.
Hlavné charakteristiky elektrolyzéra sú:
- Pracovné napätie pre jednu elektródu sa pohybuje od 1,8 do 2,0 V;
- Sila prúdu - pre normálny priebeh procesu elektrolýzy sa do elektród dodáva prúd s hodnotou tejto charakteristiky od 5 do 10 A;
- Počet elektród - minimálny počet elektród je 2, maximum je obmedzené veľkosťou samotnej inštalácie a jej účelom;
- Rozmery elektród - ako elektródy sa nepoužívajú uhlíkové tyče, ale kovové dosky, ktorých veľkosť je určená účelom inštalácie, charakteristikou prúdového napätia prúdu dodávaného do dosiek;
- Vzdialenosť medzi opačne nabitými povrchmi elektród - minimálna vzdialenosť medzi doskami elektród musí byť najmenej 1,5 mm;
- Materiál elektródy - v moderných elektrolyzéroch sa ako materiál pre anódu a katódu používa plech z nehrdzavejúcej ocele s niklom.
Ďalším dôležitým znakom zariadenia na elektrolýzu je tiež použitie katalyzátorov.
Takéto inštalácie sa používajú na nasledujúce účely:
- Získanie plynného kyslíka pozostávajúceho zo zmesi vodíka a kyslíka (Brownov plyn);
- Izolácia čistého hliníka, horčíka, zinku z ich solí;
- Čistenie vody zo solí a nečistôt v nej rozpustených;
- Aplikácia tenkej vrstvy niklu, zinku, ktorá zabraňuje korózii na povrchu kovových častí;
- Dezinfekcia potravinových výrobkov;
- Čistenie odpadových vôd z rozpustených solí ťažkých kovov a iných škodlivých látok.
Dôležité! Platinová elektróda vyrobená z obyčajného železa sa v elektrolýznych zariadeniach používa menej často ako z nehrdzavejúcej ocele, pretože rýchlejšie oxiduje a stáva sa nepoužiteľnou.
Vlastnoručne vyrobený elektrolyzér
Každý si môže vyrobiť elektrolyzér vlastnými rukami. Pre montážny proces najbežnejšieho dizajnu budú potrebné tieto materiály:
- plech z nehrdzavejúcej ocele (najlepšie možnosti sú zahraničné AISI 316L alebo naše 03X16H15M3);
- skrutky М6х150;
- podložky a matice;
- priehľadná trubica - môžete použiť vodováhu, ktorá sa používa na stavebné účely;
- niekoľko tvarov rybej kosti s vonkajším priemerom 8 mm;
- plastová nádoba s objemom 1,5 litra;
- malý filter filtrujúci vodu z vodovodu, napríklad filter pre práčky;
- spätný vodný ventil.
Montážny proces
Zozbierajte elektrolyzér vlastnými rukami podľa nasledujúcich pokynov:
- Najskôr je potrebné označiť a následné pílenie plechu z nehrdzavejúcej ocele na rovnaké štvorce. Pílenie je možné vykonať pomocou uhlovej brúsky (uhlová brúska). Jeden z rohov takýchto štvorcov musí byť šikmo prerezaný, aby sa platne správne zaistili;
- Ďalej musíte urobiť otvor pre skrutku na bočnej strane dosky naproti rezu rohovej pílky;
- Pripojenie dosiek by sa malo vykonať postupne: jedna doska na "+", ďalšia na "-" a tak ďalej;
- Medzi rôzne nabitými platňami by mal byť izolátor, ktorý funguje ako trubica z vodováhy.Mal by byť nakrájaný na krúžky, ktoré by mali byť pozdĺžne rozrezané, aby sa získali pásy s hrúbkou 1 mm. Táto vzdialenosť medzi doskami je dostatočná na dobrý vývoj plynu počas elektrolýzy;
- Dosky sú k sebe pripevnené pomocou podložiek nasledujúcim spôsobom: na skrutku sedí podložka, potom doska, potom tri podložky, po doske atď. Dosky, priaznivo nabité, sú umiestnené v zrkadlovom obraze negatívne nabitých hárkov. To umožňuje zabrániť tomu, aby sa pílené hrany dotýkali elektród;


Dosky zariadenia na elektrolýzu sa spojili
- Pri zostavovaní dosiek by ste ich mali súčasne izolovať a utiahnuť matice;
- Každá platňa musí byť tiež krúžkovaná, aby sa zabezpečilo, že nedošlo ku skratu;
- Ďalej musí byť celá zostava umiestnená v plastovej krabici;
- Potom stojí za to zvýrazniť miesta, kde sa skrutky dotýkajú stien nádoby, kde vyvŕtate dva otvory. Ak sa skrutky nezmestia do nádoby, je potrebné ich rezať pilkou na kov;
- Potom sa skrutky utiahnu maticami a podložkami kvôli tesnosti konštrukcie;


Dosky umiestnené v plastovej nádobe
- Po vykonaných krokoch budete musieť urobiť otvory vo veku nádoby a vložiť do nich armatúry. Nepriepustnosť je v tomto prípade možné zabezpečiť utesnením spojov tmelmi na báze silikónu;
- Poistný ventil a filter v konštrukcii sú umiestnené na výstupe plynu a slúžia ako prostriedok na riadenie nadmerného hromadenia plynu, ktoré môže viesť k zlým výsledkom;
- Elektrolýzna jednotka je zmontovaná.
Poslednou fázou je test, ktorý sa vykonáva podobným spôsobom:
- naplnenie nádoby vodou až po značku skrutiek pre spojovacie prvky;
- pripojenie napájania k zariadeniu;
- pripojenie k tvarovke rúry, ktorej opačný koniec je spustený do vody.
Ak je do zariadenia privádzaný slabý prúd, potom bude uvoľňovanie plynu cez trubicu takmer nepostrehnuteľné, ale bude možné ho sledovať z vnútra elektrolyzéra. Zvýšením striedavého prúdu a pridaním alkalického katalyzátora do vody možno výrazne zvýšiť výťažok plynu.
Vyrobený elektrolyzér je spravidla dôležitou súčasťou mnohých zariadení, napríklad vodíkovým horákom.


vzhľad vodíkového horáka, ktorého základ sa považuje za svojpomocne vyrobený elektrolyzér
Ak poznáte typy, kľúčové vlastnosti, zariadenie a princíp práce iónových inštalácií, môžete vykonať správnu montáž domácej konštrukcie, ktorá je vynikajúcim pomocníkom v rôznych každodenných situáciách: od zvárania a úspory spotreby paliva motorových vozidiel po fungovanie vykurovacích systémov.
Zariadenie a princíp činnosti
Katóda a anóda
Najjednoduchšie zariadenie na elektrolýzu sa skladá z niekoľkých „článkov“, z ktorých každý obsahuje:
- 2 doskové elektródy - katódové (záporné) a anódy (kladné);
- Gumové tesnenie po obvode dvoch susedných odlišných elektród.
Vonkajšie články sú vybavené špeciálnymi rúrkami, ktorými sú odvádzané vyvíjané plyny.
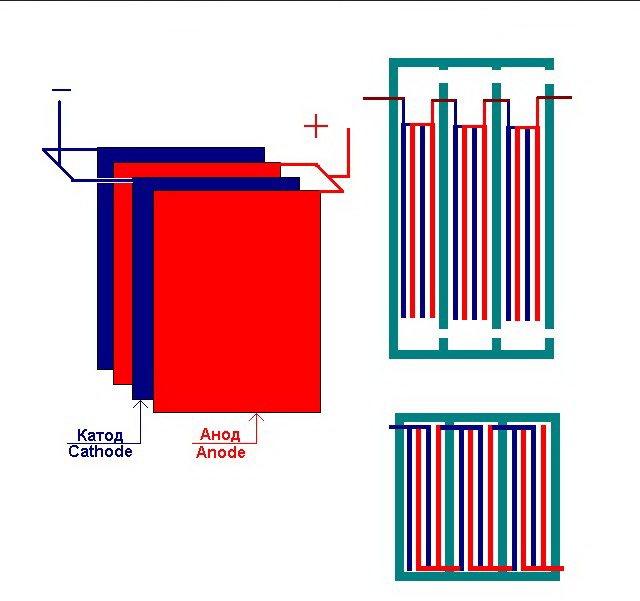

Niekoľko vzájomne prepojených „článkov“ zariadenia na elektrolýzu
Elektrolyzér môže obsahovať od 1 do 30 - 40 alebo viac takýchto „článkov“, dosky s rovnakým názvom sú spojené do série.
Dôležité! Pri použití napájacích zdrojov so striedavým prúdom sa dodatočne používajú usmerňovače, z ktorých najjednoduchší je diódový mostík.
Takáto inštalácia funguje nasledovne:
- Do priestoru medzi elektródami sa naleje destilovaná voda s rozpustenou zásadou alebo obyčajná sóda bikarbóna;
- Z napájacieho zdroja na elektródy všetkých článkov inštalácie sa dodáva napätie 1,8 - 2,0 V;
- Výsledkom procesu elektrolýzy sú anionty (kladne nabité ióny) látky rozpustenej vo vode priťahované k záporne nabitej katóde, v dôsledku čoho sa na nej vytvorí tenký sodíkový film;
- Na kladne nabitej anóde dochádza k deštrukcii molekúl vody, pričom každý z nich vytvorí 2 atómy vodíka a 1 atóm kyslíka;
- Uvoľnený detonačný plyn cez odbočné potrubie vstupuje do nádoby na to určenej.
Intenzita procesu elektrolýzy závisí od napätia a sily prúdu - pri nízkych hodnotách týchto charakteristík proces nebude pokračovať. Ak zdroj energie dodáva prúd s príliš vysokými hodnotami charakteristiky prúdového napätia, roztok nalievaný do elektrolyzéra bude veľmi horúci a vyvarí sa.
Ladenie a testovanie zariadenia
Potom je potrebné určiť, kde sa skrutky dotýkajú stien skrinky, a na týchto miestach vyvŕtať dva otvory. Ak sa bez zjavného dôvodu ukáže, že skrutky nezapadajú do nádoby, mali by narezať a dotiahnuť na utiahnutie maticami... Teraz musíte vyvŕtať kryt a zasunúť tam závitové konektory z oboch strán. Aby sa zabezpečila nepriepustnosť, mal by byť spoj utesnený tmelom na báze silikónu.
Po zostavení vlastného elektrolyzéra vlastnými rukami by ste ho mali vyskúšať. Za týmto účelom pripojte zariadenie k zdroju napájania, naplňte ho vodou po skrutky, nasaďte viečko pripojením hadice k armatúre a spustením opačného konca hadice do vody. Ak je prúd slabý, bude prúd viditeľný zvnútra elektrolyzéra.
Postupne zvyšujte prúd vo vašom domácom spotrebiči. Destilovaná voda nevedie dobre elektrinu, pretože neobsahuje žiadne soli ani nečistoty. Na prípravu elektrolytu je potrebné do vody pridať zásadu. Aby ste to dosiahli, musíte si vziať hydroxid sodný (obsiahnutý v čističoch rúr typu "Mole"). Aby sa zabránilo hromadeniu slušného množstva plynu, je potrebný poistný ventil.
- Ako katalyzátor je lepšie použiť destilovanú vodu a sódu.
- Niektorú sódu bikarbónu by ste mali zmiešať so štyridsiatimi dielmi vody. Steny po stranách sú najlepšie z akrylového skla.
- Elektródy sú najlepšie vyrobené z nehrdzavejúcej ocele. Má zmysel používať zlato na taniere.
- Na podloženie použite priesvitné PVC. Môžu byť veľké 200 x 160 milimetrov.
- Na varenie jedla môžete na dokonalé spaľovanie benzínu v automobiloch a vo väčšine prípadov použiť svoj vlastný elektrolyzér.
Suché elektrolyzéry sa používajú hlavne pre stroje. Generátor zvyšuje výkon spaľovacieho motora. Vodík sa vznieti oveľa rýchlejšie ako kvapalné palivo, čím sa zvýši sila piestu. Okrem Krtka si môžete vziať Mister Muscle, lúh sodný, sódu bikarbónu.
Generátor nefunguje na pitnú vodu. Je lepšie pripojiť elektrinu takto: prvá a posledná doska - mínus a na doske uprostred - plus. Čím väčšia je plocha dosiek a čím silnejší je prúd, tým viac plynu sa uvoľní.
Typy elektrolyzérov
DIY bodové zváranie pre batérie
V závislosti od konštrukcie a princípu činnosti existuje 5 druhov elektrolýznych zariadení.
Suché
Tieto elektrolyzéry pozostávajú z doskových elektród oddelených utesnenými gumovými tesneniami. „Články“ zariadenia sú často navyše umiestnené v utesnenom kryte.
Vodík a kyslík generované v dôsledku elektrolýzy sa odstraňujú pomocou špeciálnych odbočných rúrok umiestnených na konci karosérie alebo krajných doštičiek zariadenia.
Splývavý
Elektrolýzne zariadenia tohto typu majú toto zariadenie:
- Elektrolýzny kúpeľ (telo) s dvoma dýzami, cez ktoré je do nich privádzaný elektrolyt, cez druhú je odvádzaný detonačný plyn vznikajúci v dôsledku elektrolýzy;
- Doskové elektródy oddelené rozperami;
- Nádrž s elektrolytom umiestnená nad puzdrom s elektródami a spojená hadicami s odbočnými rúrami elektrolýzneho kúpeľa zariadenia a s odbočnou rúrkou s plynovým ventilom v hornej časti.
Počas činnosti takéhoto zariadenia unikajúci plyn cez odbočné potrubie a hadica vstupuje do nádrže s elektrolytom a pri vytváraní určitého tlaku v ňom opúšťa zariadenie cez ventil na odbočnom potrubí.
Membrána
Elektrolýzne články takýchto zariadení pozostávajú z dvoch elektród oddelených tenkou membránou, ktorá umožňuje priechod produktov elektrolýzy a oddeľuje elektródy od seba.
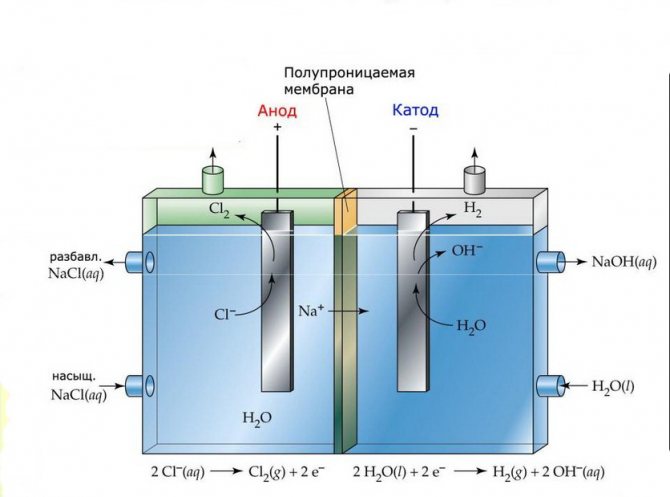

Membránová elektrolýza
Membrána
Elektrolýzne zariadenia tohto typu pozostávajú z banky v tvare písmena „U“, do ktorej sú vložené dve elektródy a 2–3 nepriepustných membrán. Podobné elektrolyzéry sa používajú na samostatnú výrobu čistého vodíka a kyslíka.
Alkalické
Na rozdiel od iných modelov elektrolyzérov sa v nich alkalický roztok používa ako elektrolyt - lúh sodný (hydroxid sodný), ktorý je nielen ďalším zdrojom vodíka a kyslíka, ale aj katalyzátorom elektrolýzy.
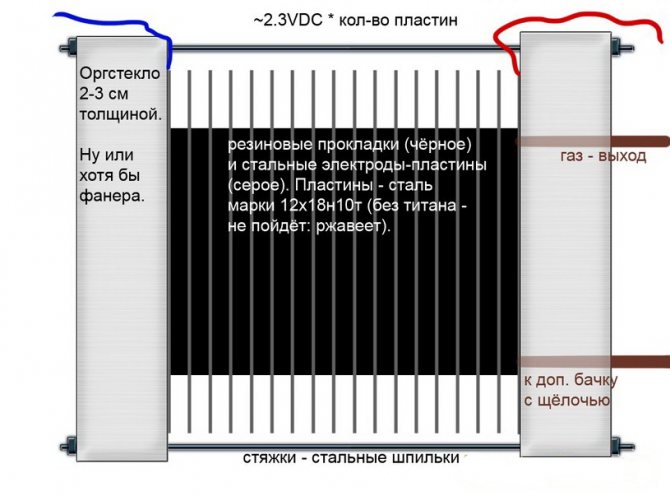

Alkalický obvod elektrolyzéra
Takéto inštalácie, na rozdiel od analógov iných typov, umožňujú použitie lacnejších elektród z obyčajného železa.
Vykonajte elektrolyzér vlastnými rukami
Určite ste oboznámení s procesom elektrolýzy z učebných osnov základnej školy. To je prípad, keď sú do vody pod prúdom vložené 2 polárne elektródy, aby sa získali kovy alebo nekovy v čistej forme. Na rozklad molekúl vody na kyslík a vodík je potrebný elektrolyzér. Elektrolyzér ako súčasť vedeckých mechanizmov rozdeľuje molekuly na ióny.
Existujú dva typy tohto zariadenia:
- Suchý elektrolyzér (toto je úplne uzavretý článok);
- Mokrý elektrolyzér (sú to dve kovové platne umiestnené v nádobe s vodou).
Toto zariadenie je z hľadiska zariadenia jednoduché, čo to umožňuje používať aj doma... Elektrolyzéry rozdeľujú náboje elektrolýzy atómov molekúl na nabité atómy.
V našom prípade rozdeľuje vodu na pozitívny vodík a negatívny kyslík. Na to je potrebné veľké množstvo energie a na zníženie potrebnej energie sa používa katalyzátor.
Elektrolyzér na výrobu vodíka
Výpočet uzemnenia
Ak chcete zostaviť najjednoduchší elektrolyzér vlastnými rukami, môžete použiť výkres zobrazený na obrázku.
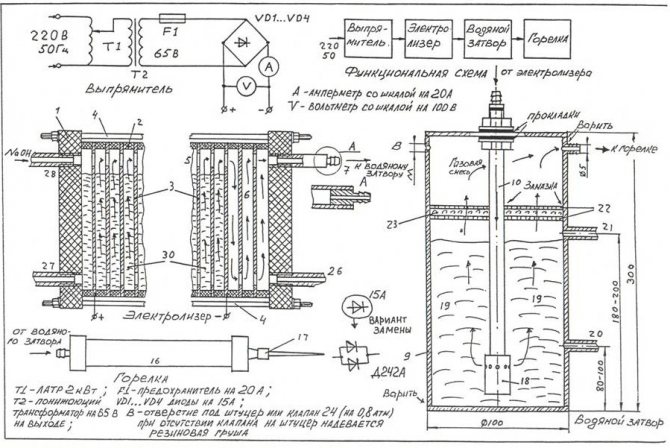

Nákres najjednoduchšieho domáceho elektrolyzéra
Poznámka! Elektrolyzér je dosť nebezpečné zariadenie, ktoré počas prevádzky môže vo veľkých množstvách hromadiť plynný vodík, ktorý spôsobí vážny výbuch. Jednotka by nemala byť umiestnená v blízkosti zdrojov otvoreného ohňa a vykurovacích zariadení.
DIY elektrolyzér pre auto
Na zlepšenie spaľovania paliva v motore automobilu sa často montuje elektrolyzér, ktorý sa skladá z puzdra zo starej batérie s doštičkami z nehrdzavejúcej ocele, z dvoch dýz, z ktorých jedna je spojená s nádržou naplnenou elektrolytom, druhá je pripojený k hadici na prívod vzduchu k motoru (presnejšie zvlnené od prívodu vzduchu k vzduchovému filtru).
Takýto domáci tečúci elektrolyzér je napájaný z batérie automobilu pomocou relé a 10 A poistky.
Vytvárame zariadenie vlastnými rukami
Zariadenie na tento proces je možné vykonať ručne.
Na to budete potrebovať:
- Plech z nehrdzavejúcej ocele;
- Skrutky M6 x 150;
- Podložky;
- Orechy;
- Priehľadná trubica;
- Spojovacie prvky so závitom na oboch stranách;
- Jeden a pol litra plastovej nádoby;
- Vodný filter;
- Spätný ventil na prítomnosť vody.
Vynikajúcou voľbou pre nehrdzavejúcu oceľ je AISI 316L zahraničného výrobcu alebo 03X16H15M3 výrobcu z našej krajiny. Nie je absolútne potrebné kupovať nehrdzavejúcu oceľ, môžete si vziať starú. Stačí vám 50 až 50 centimetrov.
„Prečo brať samotnú nehrdzavejúcu oceľ?“ - pýtaš sa. Pretože najbežnejší kov bude korodovať. Nerezová oceľ lepšie znáša alkálie. Mal by obrys listu tak, aby sa rozdelil na 16 podobných štvorcov... Môžete ho rezať pomocou uhlovej brúsky. V každom štvorci vyrežte jeden z rohov.
Na druhej strane a protiľahlom rohu z odpíleného rohu vyvŕtajte otvor pre skrutku, ktorá pomôže držať platne pohromade. Elektrolyzér neprestáva fungovať takto:t dosková elektrina prúdi na dosku - a voda sa rozkladá na kyslík a vodík. Vďaka tomu potrebujeme dobrý a negatívny tanier.
Dosky musia byť spojené striedavo: plus-mínus-plus-mínus, pri podobnej metóde bude silný prúd. Na izoláciu dosiek jedna od druhej sa používa rúrka. Z úrovne je vyrezaný krúžok. Jeho rozrezaním získame pás hrúbky milimetra. Táto vzdialenosť je správnejšia na výrobu plynu.
Dosky sú navzájom spojené s podložkami: na skrutku nasadíme podložku, potom dosku a tri podložky, potom opäť dosku a podobne. Plusom a mínusom musí byť vysadených osem tanierov. Ak je všetko vykonané správne, potom sa rezy dosiek nedotknú elektród.
Potom musíte dotiahnuť matice a izolovať platne. Potom umiestnime konštrukciu do plastovej nádoby.
Prehľad výrobcov elektrolyzéra
Hlavnými výrobcami elektrolyzérov sú domáce podniky (RUSAL, NPF RutTech, JSC Uralkhimmash), ako aj ich zahraniční konkurenti - Teledyne Energy Systems, Inc. (USA), Hydrogenics Corp. (Belgicko).
Elektrolyzér je teda pomerne jednoduchá a na funkcie bohatá inštalácia používaná na výrobu plynného kyslíka, ktorá sa v budúcnosti plánuje používať ako palivo pre spaľovacie motory a vykurovacie kotly.
Domáca elektrolýza si urobte sami
Keď som bol malý, vždy som chcel niečo robiť sám, vlastnými rukami. Ale rodičia (a ďalší blízki ľudia) to vo väčšine prípadov nedovolili. A nevidel som vtedy (a doteraz nevidím) nič zlé, keď sa malé deti chcú učiť ??
Tento článok som samozrejme nenapísal preto, aby som si pripomenul zážitky z detstva v túžbe začať sebavzdelávanie. Len tak náhodou, keď som surfoval na internete, narazil som na otázku tohto druhu. Nejaký malý chlapec z bombardéra sa pýtal, ako sa robí elektrolýza doma. Je pravda, že som mu neodpovedal, pretože tento chlapec chcel elektrolyzovať bolestivo podozrivú zmes ?? Rozhodol som sa, že už z hriechu nepoviem ďalej, nech sa pozriem do kníh sám. Ale nie je to tak dávno, čo som opäť putoval po fórach, videl som podobnú otázku od učiteľa na chemickej škole. Podľa popisu je jeho škola taká zlá, že si nemôže (nechce) kúpiť elektrolyzér za 300 rubľov. Učiteľ (aký problém!) Nenašiel východisko z výslednej situácie. Tak som mu pomohol. Pre tých, ktorí sú zvedaví na tento druh domácich výrobkov, uverejňujem tento článok na webe.
V skutočnosti je výrobný proces a použitie našej vlastnej palety veľmi primitívne. Ale najskôr vám poviem o bezpečnosti a o výrobe až potom. Ide o to, že hovoríme o demonštračnom elektrolyzéri, a nie o priemyselnom závode. Vďaka tomu bude kvôli bezpečnosti dobré napájať ho nie zo siete, ale z AA batérií alebo z batérie. Prirodzene, čím vyššie napätie, tým rýchlejšie bude prebiehať proces elektrolýzy. Avšak na vizuálne pozorovanie plynových bublín je to celkom dosť 6 V, ale 220 je už nadmerných. s takýmto napätím bude voda napríklad vrieť najrýchlejšie a to nie je veľmi bezpečné ... No, myslím, že ste prišli na napätie?
Teraz si povieme, kde a za akých podmienok budeme experimentovať. Úplne prvá vec by to mal byť buď voľný priestor, alebo dobre vetraná miestnosť. Aj keď som všetko robil v byte so zatvorenými oknami a nič podobné? Po druhé, experiment sa najlepšie uskutoční na dobrom stole. Slovo „dobrý“ znamená, že stôl musí byť stabilný a lepšie ťažký, tuhý a pripevnený k povrchu podlahy. V takom prípade musí byť poťah stola odolný voči agresívnym látkam. Mimochodom, dlaždice z dlaždice je na to ideálna (aj keď nie každá, bohužiaľ). Takáto tabuľka sa bude hodiť nielen pre tento zážitok. Všetko som však robil na obyčajnej stolici ?? Po tretie, počas experimentu nemusíte presúvať zdroj energie (v mojom prípade batérie). Z tohto dôvodu je kvôli spoľahlivosti najlepšie okamžite položiť ich na stôl a zafixovať ich tak, aby sa nepohli. Verte mi, že je to pohodlnejšie ako ich pravidelné držanie rukami. K prvému tvrdému predmetu, ktorý som uvidel, som si jednoducho pripevnil elektrickou páskou vlastné batérie. Po štvrté, jedlá, v ktorých budeme experimentovať, nech sú malé. Jednoduché sklo sa hodí alebo panák. Mimochodom, toto je najoptimálnejší spôsob, ako používať okuliare doma, na rozdiel od nalievania alkoholu do nich s ďalším používaním ...
No, poďme teraz konkrétne k zariadeniu. Je to uvedené na obrázku, ale zatiaľ stručne vysvetlím, čo a čo.
Musíme zobrať jednoduchú ceruzku a odstrániť z nej strom obyčajným nožom a z ceruzky dostať celé vodítko. Z mechanickej ceruzky si však môžete vziať náskok. Existujú však dve ťažkosti naraz. Prvý je obvyklý. Olovo z mechanickej ceruzky je príliš tenké, pre nás to jednoducho nie je vhodné na vizuálny experiment. Druhou ťažkosťou je akési nepochopiteľné zloženie súčasných bridlíc. Má pocit, že nie sú vyrobené z grafitu, ale z niečoho iného. Všeobecne moje skúsenosti s takýmto „olovom“ neboli vôbec úspešné, ani pri napätí 24 V. Vďaka tomu som potreboval vybrať dobrú drevitú jednoduchú ceruzku. Výsledná grafitová tyč bude pre nás slúžiť ako elektróda. Ako si viete predstaviť, potrebujeme dve elektródy. Vďaka tomu ideme vybrať druhú ceruzku, alebo jednoducho zlomíme existujúcu tyč na dve časti. Vlastne som to urobil.
Každým drôtom, ktorý sa vám dostane pod ruku, zabalíme prvú olovenú elektródu (jedným koncom drôtu) a tento vodič pripojíme k zápornému pólu zdroja energie (druhým koncom). Potom vezmeme druhé vedenie a urobíme to isté s ním. Na to, na základe toho, potrebujeme druhý drôt. Ale v tomto prípade pripojíme tento vodič k plusu napájacieho zdroja. Ak máte problémy s pripevnením krehkej grafitovej tyče na drôt, môžete použiť príslušné nástroje, napríklad pásku alebo lepiacu pásku. Ak sa nepodarilo obaliť hrot grafitu samotným drôtom a páska alebo izolačná páska neposkytovali tesný kontakt, skúste elektródu prilepiť vodivým lepidlom. Ak toto nemáte, tak aspoň priviažte elektródu k drôtu niťou. Netreba sa báť, niť sa z takého napätia nevyhorí ??
Pre tých, ktorí nevedia nič o batériách a jednoduchých pravidlách ich pripájania, trochu vysvetlím. Batéria typu prst produkuje napätie 1,5 V. Na obrázku mám dve podobné batérie. Navyše sú prepojené postupne - jeden po druhom, nie súbežne. Pri podobnom (sériovom) zapojení bude konečné napätie sčítané z napätia každej batérie, to znamená, že pre mňa je to 1,5 + 1,5 = 3,0 V. To je menej ako predtým uvedených 6 voltov. Ale bol som príliš lenivý na to, aby som si išiel kúpiť ešte pár batérií. Princíp ti musí byť jasný ??
Začnime experiment. Napríklad sa obmedzíme na elektrolýzu vody.Po prvé, je veľmi prístupný (dúfam, že čitateľ tohto článku nežije na Sahare), po druhé je neškodný. Ďalej ukážem, ako pri rovnakom prístroji (elektrolyzéri) s rovnakou látkou (voda) vykonať dva rôzne skúsenosti. Myslím, že máte dosť fantázie, aby ste prišli na kopu podobných experimentov s inými látkami ?? Všeobecne je pre nás vhodná voda z vodovodu. Ale odporúčam ho ešte trochu pridať a posoliť. Trochu - to znamená malú štipku, nie celú dezertnú lyžicu. Toto je dôležité! Soľ dobre premiešame, aby sa rozpustila. Voda, ktorá je dielektrikom v čistom stave, bude teda dokonale viesť elektrinu. na začiatku experimentu utrite stôl od potenciálnej vlhkosti a potom naň položte zdroj energie a pohár vody.
Obidve elektródy, ktoré sú pod napätím, spustíme do vody. Zároveň sa uistite, že vo vode je ponorený iba grafit a samotný drôt by sa nemal dotýkať vody. Začiatok experimentu sa môže oneskoriť. Čas závisí od mnohých ukazovateľov: od zloženia vody, kvality drôtov, kvality grafitu a samozrejme od napätia zdroja energie. Začiatok mojej reakcie sa na pár sekúnd oneskoril. Kyslík sa začína vyvíjať na elektróde, ktorá bola pripojená k pólu plus batérií. Na elektróde pripojenej k mínusu sa uvoľní vodík. Treba poznamenať, že vodíkových bublín je viac. Veľmi malé bublinky sa lepia okolo časti grafitu, ktorá je ponorená vo vode. Potom začnú niektoré bublinky plávať.
Elektróda na začiatku experimentu. Zatiaľ nie sú žiadne plynové bubliny. Na elektróde pripojenej k zápornému pólu batérií sa tvorili vodíkové bubliny
Aké ďalšie experimenty môžu byť? Ak ste si už dosť zahrali s vodíkom a kyslíkom, pokračujeme ďalším experimentom. Je to zaujímavejšie, najmä pre domácich výskumníkov. Je zaujímavý tým, že je možné ho nielen vidieť, ale aj cítiť. V minulosti sme dostávali kyslík a vodík, ktoré podľa môjho názoru nie sú veľmi pôsobivé. A v ďalšom experimente dostaneme dve látky (mimochodom užitočné v každodennom živote). na začiatku experimentu zastavte predchádzajúci experiment a elektródy vysušte. Teraz vezmite kuchynskú soľ (ktorú bežne používate v kuchyni) a rozpustite ju vo vodnej hmote. V tomto prípade nie malé množstvo. Slušné množstvo soli je v skutočnosti jediná vec, vďaka ktorej sa druhá skúsenosť líši od prvej. Po rozpustení soli môžete experiment okamžite zopakovať. Teraz prebieha iná reakcia. Na dobrej elektróde sa teraz neuvoľňuje kyslík, ale chlór. A negatívne je, že sa uvoľňuje aj vodík. Pokiaľ ide o sklo, v ktorom je soľný roztok, zostáva v ňom po dlhšej elektrolýze hydroxid sodný. Toto je známa lúh sodný, alkalický.
Chlór, budete ho cítiť. Ale pre najlepší efekt odporúčam vziať napätie minimálne 12 V. V opačnom prípade nemusíte arómu cítiť. Prítomnosť zásady (po veľmi dlhej elektrolýze) v skle sa dá skontrolovať niekoľkými spôsobmi. Najjednoduchšie a najnásilnejšie je položiť ruku do pohára. Etnické znamenie hovorí, že ak začne horieť, v pohári je alkália. Inteligentnejším a zreteľnejším spôsobom je lakmusový papierik. Ak je vaša škola taká chudobná, že nie je schopná získať lakmusový papier, pomôžu vám šikovné ukazovatele. Jeden z nich, ako sa hovorí, môže slúžiť ako kvapka repného džúsu ?? Je ale celkom možné, že do roztoku nakvapkáte trochu tuku. Pokiaľ viem, malo by dôjsť k zmydelneniu.
Pre veľmi zvedavých popíšem, čo sa vlastne stalo počas experimentov. V prvom experimente pod vplyvom elektrického prúdu prebehla podobná reakcia: 2 H2O >>> 2 H2 + O2 Oba plyny prirodzene plávajú z vody na povrch. Mimochodom, môžu sa zachytávať plávajúce plyny. Zvládnete to aj vy?
V ďalšom experimente bola reakcia úplne iná.Bolo to tiež iniciované elektrickým prúdom, ale teraz ako reagenty pôsobila nielen voda, ale aj soľ: 4H20 + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Majte na pamäti, že reakcia musí prebiehať v prebytku vody. Ak chcete zistiť, aké množstvo soli sa považuje za najväčšie, môžete ho spočítať z vyššie uvedenej reakcie. Stále môžete uvažovať o tom, ako vylepšiť zariadenie alebo aké ďalšie experimenty je možné vykonať. Je skutočne možné, že chlórnan sodný sa dá získať elektrolýzou. Za laboratórnych podmienok sa vo väčšine prípadov získava prechodom plynného chlóru cez roztok hydroxidu sodného.